지질 이중층
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
지질 이중층은 인지질 분자들이 소수성 꼬리를 서로 마주보게 하고 친수성 머리를 바깥으로 향하게 하여 형성하는 이중 구조이다. 이러한 구조는 세포막의 기본 단위이며, 지방산의 길이, 불포화도, 콜레스테롤 유무에 따라 유연성이 달라진다. 지질 이중층은 세포 내부와 외부를 격리하고, 신호 전달 및 세포 간 상호작용에 중요한 역할을 한다. 연구 방법으로는 전기 생리학적 측정, 형광 현미경, 전자 현미경, 원자 힘 현미경, 분자 동역학 시뮬레이션 등이 사용되며, 약물 전달, 바이오센서, 인공 세포 분야에 응용된다. 20세기 초에 지질 이중층의 존재가 제안되었고, 전자 현미경과 모델 막 개발을 통해 구조가 확인되었다.
더 읽어볼만한 페이지
- 막생물학 - 포스파티딜에탄올아민
포스파티딜에탄올아민은 세포막의 주요 인지질로서 동물세포에서 심장 기능, 지단백질 분비, 혈액 응고, 아난다마이드 합성에 관여하고, 세균에서는 막 인지질의 음전하 중화, 막 단백질 구조 형성, 다약물 수송체 기능에 필수적이며, 식품 내 마이야르 반응을 통해 산화 스트레스 유발 및 혈관 질환, 당뇨병과의 연관성이 연구된다. - 막생물학 - 소포 (세포)
소포는 막으로 둘러싸인 작은 주머니 모양의 구조물로, 세포 내 물질 수송, 소화, 분비, 세포간 신호 전달, 세포 외부 물질 소화 및 배출 등 다양한 기능을 수행하며, 특히 세포외소포체는 질병과의 연관성으로 주목받고 있고, 클라트린, COPI, COPII, SNARE 단백질 등이 소포 형성 및 수송에 관여한다. - 세포생물학 - 세포융합
세포융합은 둘 이상의 세포가 융합하여 하나의 세포를 만드는 과정으로, 동종 또는 이종 세포 융합으로 나뉘며 품종 개량, 단일클론 항체 생산, 질병 치료 연구 등 다양한 분야에 활용된다. - 세포생물학 - 세포막
세포막은 세포질을 둘러싸고 세포 내외부 환경을 구분하는 선택적 투과성 막으로, 인지질 이중층과 단백질, 탄수화물로 구성되어 물질 수송, 세포 형태 유지, 세포 간 신호 전달, 세포 접합 등의 기능을 수행하며, 유동 모자이크 모델로 설명된다.
2. 구조와 형성
수많은 인지질 분자가 인지질 이중층을 이룬다. 두 인지질 분자의 소수성 꼬리가 서로를 마주보고 친수성 머리가 각각 세포질과 세포 외부와 접한 이중 구조가 인지질 이중층의 기본 단위다.[5] 인지질 이중층의 유연성에 기여하는 요소에는 지방산의 길이, 지방산의 포화도, 콜레스테롤의 유무가 있다. 인지질 이중층을 이루는 지방산의 길이가 짧을수록 유연성이 증가하며, 지방산이 불포화지방산일 때 유연성이 증가한다. 가끔 콜레스테롤 분자가 인지질 이중층에 낄 때가 있는데, 보통 인체 내의 온도에서 콜레스테롤은 인지질 이중층에 유연성을 증가시킨다. 반대로 낮은 온도에서는 콜레스테롤이 유연성을 감소시킨다.
인지질이 물에 노출되면 분자 자기 조립을 통해 소수성 꼬리가 시트의 중심을 향하도록 하는 두 겹의 시트로 자기 조립된다.[122][123] 이러한 배열은 각각 단일 분자층인 두 개의 '전단지'를 생성한다. 이 이중층의 중심에는 물이 거의 없으며 물에 녹는 당이나 염과 같은 분자를 배제한다. 조립 과정과 유지 관리는 소수성 분자의 응집(소수성 효과)에 의해 구동된다. 이 복잡한 과정에는 반 데르 발스 힘, 정전기력 및 수소 결합과 같은 비공유 결합이 포함된다.[124][125]
지질 이중층은 측면 치수에 비해 매우 얇다. 전형적인 포유류 세포(직경 ~10 마이크로미터)를 수박 크기(~30 cm)로 확대하면 세포막을 구성하는 지질 이중층은 사무용 종이 한 장만큼 두꺼울 것이다. 두께가 몇 나노미터에 불과하지만 이중층은 단면을 따라 여러 개의 뚜렷한 화학적 영역으로 구성된다. 이러한 영역과 주변 물과의 상호 작용은 지난 수십 년 동안 X선 반사율,[6] 중성자 산란,[7] 및 핵 자기 공명 기술을 사용하여 특성화되었다.[8]
이중층의 양쪽에 있는 첫 번째 영역은 친수성 머리 그룹이다. 막의 이 부분은 완전히 수화되어 있으며 일반적으로 약 0.8-0.9 nm 두께이다. 인지질 이중층에서 인산염 그룹은 소수성 코어 바깥쪽 약 0.5 nm 떨어진 이 수화된 영역 내에 위치한다.[9] 어떤 경우에는 수화된 영역이 훨씬 더 확장될 수 있다. 예를 들어 단백질이 크거나 머리에 긴 설탕 사슬이 접목된 지질의 경우이다. 자연에서 이러한 변형의 일반적인 예는 박테리아 외부 막의 리포다당류 코팅이다.[10]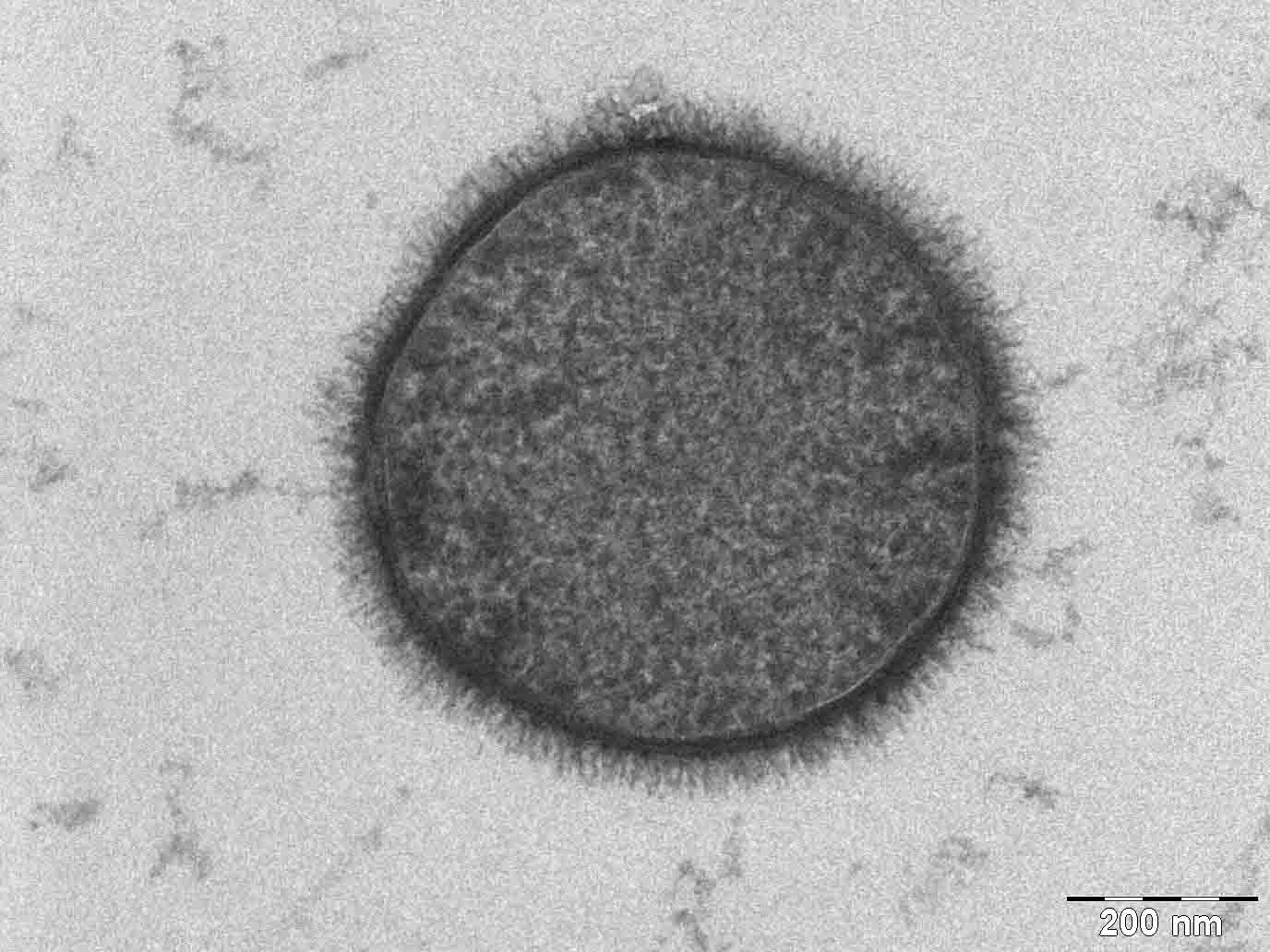
수화된 영역 옆에는 부분적으로만 수화된 중간 영역이 있다. 이 경계층은 약 0.3 nm 두께이다. 이 짧은 거리 내에서 물 농도는 머리 그룹 쪽에서 2M에서 꼬리(코어) 쪽에서 거의 0으로 떨어진다.[11][12] 이중층의 소수성 코어는 일반적으로 3-4 nm 두께이지만 이 값은 사슬 길이 및 화학에 따라 다릅니다.[6][13] 코어 두께는 또한 특히 상 전이 근처에서 온도에 따라 크게 달라진다.[14]
친수성 인산 부분의 머리에 소수성인 지방산이 2개의 꼬리로 붙어있는 것이 인지질 분자이다. 세포의 안팎은 주로 물로 채워져 있으므로 인지질 분자는 머리 부분을 바깥쪽으로, 물에 반발하는 꼬리 부분을 안쪽으로 하여 두께가 3.5-5.6 나노미터 정도의 두께의 이중층을 만들어 정렬한다.[122][123] 이중층의 양쪽 바깥쪽은 친수성이므로 막 전체는 세포 안팎의 환경에 친숙하며, 안쪽에는 소수성 지방산이 가득 차 있으므로 세포 안팎을 확실히 차단할 수 있다. 이 지질 이중층은 전기적으로 중성이며 극히 작은 분자, 예를 들어 산소 분자나 이산화탄소 분자는 통과시키지만, 극성을 가진 물 분자는 통과하기 어렵고, 큰 분자나 이온은 통과할 수 없다.[124][125]
인지질 분자 간의 결합은 느슨하므로, 각 인지질 분자는 지질 이중층 안에서 가로 방향으로 자유롭게 이동할 수 있으며, 또한 혈장 중의 인지질 분자가 지질 이중층에 들어가거나, 반대로 혈장으로 빠져나가는 것도 가능하다. 또한 지질 이중층을 관통하고 있는 막 관통 단백질이나 수용체 등도 막 지질 이중층 위를 이동할 수 있다(막 골격에 앵커되어 있는 것은 막 골격의 자유도 범위 내에서 움직일 수 있다).[125][126]
이 인지질 분자에는 인산의 끝에 붙은 분자에 따라 포스파티딜콜린(PC), 스핑고마이엘린(SM), 포스파티딜에탄올아민(PE), 포스파티딜세린(PS) 등이 알려져 있다. 각각의 비율은 세포에 따라 크게 다르지만, 한 예로 가장 분석이 진척된 인간의 적혈구의 막 지질 이중층에서는 PC가 21%, PS와 PE가 합쳐서 29%, SM이 21%, 콜레스테롤이 26%, 기타가 수 %로 구성된다.[127]
정렬된 인지질 분자 사이에 콜레스테롤이 들어가면 분자가 움직일 수 있는 자유도가 저하되고, 막은 딱딱해져 유연성이 약해진다. 막 지질 이중층의 많은 부분에서는 콜레스테롤이 많지 않으므로 인지질 분자는 비교적 자유롭게 움직일 수 있다.[128][129]
PC나 PS, PE, SM 등의 인지질 분자는 이중층의 바깥쪽(혈장 측)과 안쪽(세포질 측)에서 분포에 차이가 있으며, 예를 들어 적혈구에서는 바깥쪽에는 PC, SM과 당지질이 많고, 안쪽에는 PE, PS가 많아 비대칭 분포를 이룬다. 인지질 분자의 막의 앞뒤 간의 이동은 3 종류의 효소가 관여하고 있으며, flippase는 PE, PS를 막의 바깥쪽(혈장 측)에서 안쪽(세포질 측)으로 이동시키고, floppase는 모든 지질 분자를 안쪽에서 바깥쪽으로 이동시키며, scramblase는 모든 분자를 양방향으로 혼동한다. 이러한 효소의 작용에 의해 막 안팎의 인지질의 비대칭 분포가 이루어진다고 생각된다.[126][130] 비대칭 분포의 한 가지 이유로, 주요 인지질 중에서 PS는 음전하를 띠고, 세포질 내 단백질이 가진 양전하와 상호 작용하기 쉬운 것이 세포막의 기능에 유리하기 때문이라고 생각된다.[131]
인지질 이중층 막 위에는 다른 부분보다 약간 두껍고 약간 단단한 지질 이중층 위를 이동할 수 있는 영역이 있으며, 바다에 떠 있는 뗏목에 비유되어 지질 라프트(Lipid Raft)라고 불린다. 라프트 부분에서는 인지질은 주로 스핑고미엘린(SM)으로 구성되며, SM 분자 사이에 콜레스테롤 분자가 매우 많이 들어가 분자 간의 결합을 강화하고 있다. 라프트에는 SM과 콜레스테롤 외에도 막 관통 단백질이나 수용체, 당지질 등도 많이 존재한다.[132][133]
2. 1. 인지질의 구조
인지질은 글리세롤 또는 스핑고신 골격에 두 개의 지방산 사슬과 인산기가 결합된 형태이다.[5] 인산기에는 콜린, 에탄올아민, 세린, 이노시톨 등 다양한 극성 분자가 결합하여 다양한 종류의 인지질을 형성한다. 지방산 사슬의 길이와 포화도는 지질 이중층의 유동성과 안정성에 영향을 미친다.[5]수많은 인지질 분자가 인지질 이중층을 이룬다. 두 인지질 분자의 소수성 꼬리가 서로를 마주보고 친수성 머리가 각각 세포질과 세포 외부와 접한 이중 구조가 인지질 이중층의 기본 단위다.[5] 인지질 이중층의 유연성에 기여하는 요소에는 지방산의 길이, 지방산의 포화도, 콜레스테롤의 유무가 있다. 인지질 이중층을 이루는 지방산의 길이가 짧을수록 유연성이 증가하며, 지방산이 불포화지방산일 때 유연성이 증가한다. 가끔 콜레스테롤 분자가 인지질 이중층에 낄 때가 있는데, 보통 인체 내의 온도에서 콜레스테롤은 인지질 이중층에 유연성을 증가시킨다. 반대로 낮은 온도에서는 콜레스테롤이 유연성을 감소시킨다.[5]지질 이중층은 측면 치수에 비해 매우 얇다. 전형적인 포유류 세포(직경 ~10 마이크로미터)를 수박 크기(~30 cm)로 확대하면 세포막을 구성하는 지질 이중층은 사무용 종이 한 장만큼 두꺼울 것이다. 두께가 몇 나노미터에 불과하지만 이중층은 단면을 따라 여러 개의 뚜렷한 화학적 영역으로 구성된다. 이러한 영역과 주변 물과의 상호 작용은 지난 수십 년 동안 X선 반사율,[6] 중성자 산란,[7] 및 핵 자기 공명 기술을 사용하여 특성화되었다.[8]
이중층의 양쪽에 있는 첫 번째 영역은 친수성 머리 그룹이다. 막의 이 부분은 완전히 수화되어 있으며 일반적으로 약 0.8-0.9 nm 두께이다. 인지질 이중층에서 인산염 그룹은 소수성 코어 바깥쪽 약 0.5 nm 떨어진 이 수화된 영역 내에 위치한다.[9] 어떤 경우에는 수화된 영역이 훨씬 더 확장될 수 있다. 예를 들어 단백질이 크거나 머리에 긴 설탕 사슬이 접목된 지질의 경우이다. 자연에서 이러한 변형의 일반적인 예는 박테리아 외부 막의 리포다당류 코팅이다.[10]
수화된 영역 옆에는 부분적으로만 수화된 중간 영역이 있다. 이 경계층은 약 0.3 nm 두께이다. 이 짧은 거리 내에서 물 농도는 머리 그룹 쪽에서 2M에서 꼬리(코어) 쪽에서 거의 0으로 떨어진다.[11][12] 이중층의 소수성 코어는 일반적으로 3-4 nm 두께이지만 이 값은 사슬 길이 및 화학에 따라 다릅니다.[6][13] 코어 두께는 또한 특히 상 전이 근처에서 온도에 따라 크게 달라진다.[14]
2. 2. 지질 이중층의 형성
인지질이 물에 노출되면 분자 자기 조립을 통해 소수성 꼬리가 시트의 중심을 향하도록 하는 두 겹의 시트로 자기 조립된다.[122][123] 이러한 배열은 각각 단일 분자층인 두 개의 '전단지'를 생성한다. 이 이중층의 중심에는 물이 거의 없으며 물에 녹는 당이나 염과 같은 분자를 배제한다. 조립 과정과 유지 관리는 소수성 분자의 응집(소수성 효과)에 의해 구동된다. 이 복잡한 과정에는 반 데르 발스 힘, 정전기력 및 수소 결합과 같은 비공유 결합이 포함된다.[124][125]친수성 인산 부분의 머리에 소수성인 지방산이 2개의 꼬리로 붙어있는 것이 인지질 분자이다. 세포의 안팎은 주로 물로 채워져 있으므로 인지질 분자는 머리 부분을 바깥쪽으로, 물에 반발하는 꼬리 부분을 안쪽으로 하여 두께가 3.5-5.6 나노미터 정도의 두께의 이중층을 만들어 정렬한다.[122][123] 이중층의 양쪽 바깥쪽은 친수성이므로 막 전체는 세포 안팎의 환경에 친숙하며, 안쪽에는 소수성 지방산이 가득 차 있으므로 세포 안팎을 확실히 차단할 수 있다. 이 지질 이중층은 전기적으로 중성이며 극히 작은 분자, 예를 들어 산소 분자나 이산화탄소 분자는 통과시키지만, 극성을 가진 물 분자는 통과하기 어렵고, 큰 분자나 이온은 통과할 수 없다.[124][125]
인지질 분자 간의 결합은 느슨하므로, 각 인지질 분자는 지질 이중층 안에서 가로 방향으로 자유롭게 이동할 수 있으며, 또한 혈장 중의 인지질 분자가 지질 이중층에 들어가거나, 반대로 혈장으로 빠져나가는 것도 가능하다. 또한 지질 이중층을 관통하고 있는 막 관통 단백질이나 수용체 등도 막 지질 이중층 위를 이동할 수 있다(막 골격에 앵커되어 있는 것은 막 골격의 자유도 범위 내에서 움직일 수 있다).[125][126]
이 인지질 분자에는 인산의 끝에 붙은 분자에 따라 포스파티딜콜린(PC), 스핑고마이엘린(SM), 포스파티딜에탄올아민(PE), 포스파티딜세린(PS) 등이 알려져 있다. 각각의 비율은 세포에 따라 크게 다르지만, 한 예로 가장 분석이 진척된 인간의 적혈구의 막 지질 이중층에서는 PC가 21%, PS와 PE가 합쳐서 29%, SM이 21%, 콜레스테롤이 26%, 기타가 수 %로 구성된다.[127]
정렬된 인지질 분자 사이에 콜레스테롤이 들어가면 분자가 움직일 수 있는 자유도가 저하되고, 막은 딱딱해져 유연성이 약해진다. 막 지질 이중층의 많은 부분에서는 콜레스테롤이 많지 않으므로 인지질 분자는 비교적 자유롭게 움직일 수 있다.[128][129]
PC나 PS, PE, SM 등의 인지질 분자는 이중층의 바깥쪽(혈장 측)과 안쪽(세포질 측)에서 분포에 차이가 있으며, 예를 들어 적혈구에서는 바깥쪽에는 PC, SM과 당지질이 많고, 안쪽에는 PE, PS가 많아 비대칭 분포를 이룬다. 인지질 분자의 막의 앞뒤 간의 이동은 3 종류의 효소가 관여하고 있으며, flippase는 PE, PS를 막의 바깥쪽(혈장 측)에서 안쪽(세포질 측)으로 이동시키고, floppase는 모든 지질 분자를 안쪽에서 바깥쪽으로 이동시키며, scramblase는 모든 분자를 양방향으로 혼동한다. 이러한 효소의 작용에 의해 막 안팎의 인지질의 비대칭 분포가 이루어진다고 생각된다.[126][130] 비대칭 분포의 한 가지 이유로, 주요 인지질 중에서 PS는 음전하를 띠고, 세포질 내 단백질이 가진 양전하와 상호 작용하기 쉬운 것이 세포막의 기능에 유리하기 때문이라고 생각된다.[131]
2. 3. 지질 이중층의 비대칭성
자연적으로 발생하는 많은 지질 이중층에서 내막과 외막 층의 구성은 서로 다르다. 사람의 적혈구에서 내측(세포질) 층은 주로 포스파티딜에탄올아민, 포스파티딜세린 및 포스파티딜이노시톨과 그 인산화 유도체로 구성된다. 반대로, 외측(세포 외) 층은 포스파티딜콜린, 스핑고마이엘린 및 다양한 당지질을 기반으로 한다.[15][16][17]지질 비대칭성은 적어도 부분적으로 대부분의 인지질이 합성되어 처음에 내측 단층에 삽입된다는 사실에서 비롯된다. 외측 단층을 구성하는 지질은 플립페이즈라고 불리는 효소에 의해 내측 단층에서 운반된다.[19][20] 플립페이즈는 지질을 반대 방향으로 이동시키는 플롭페이즈와 지질 이중층 전체에서 지질 분포를 무작위화하는 스크램블레이즈(세포자멸사 세포에서와 같이)를 포함하는 더 큰 지질 수송 분자군에 속한다. 일단 지질 비대칭성이 확립되면, 층 사이의 지질의 자발적인 플립플롭이 매우 느리기 때문에 일반적으로 빠르게 사라지지 않는다.[21]
인지질 이중층 막 위에는 다른 부분보다 약간 두껍고 약간 단단한 지질 이중층 위를 이동할 수 있는 영역이 있으며, 바다에 떠 있는 뗏목에 비유되어 지질 라프트(Lipid Raft)라고 불린다. 라프트 부분에서는 인지질은 주로 스핑고미엘린(SM)으로 구성되며, SM 분자 사이에 콜레스테롤 분자가 매우 많이 들어가 분자 간의 결합을 강화하고 있다. 라프트에는 SM과 콜레스테롤 외에도 막 관통 단백질이나 수용체, 당지질 등도 많이 존재한다.[132][133]
어떤 경우에는 이러한 비대칭성이 지질이 세포 내에서 생성되는 위치에 기반하며, 그 초기 방향성을 반영한다.[18] 지질 비대칭성의 생물학적 기능은 불완전하게 이해되고 있지만, 여러 다른 상황에서 사용된다는 것은 분명하다. 예를 들어, 세포가 세포자멸사를 겪을 때, 일반적으로 세포질 층에 국한된 포스파티딜세린이 외측 표면으로 이동한다. 거기에서 대식세포가 이를 인식하여 죽어가는 세포를 적극적으로 청소한다.[36]
3. 물리화학적 특성
3. 1. 유동성
3. 2. 상전이
지질 이중층은 특정 온도에서 액체 또는 젤(고체) 상으로 존재할 수 있다. 모든 지질은 젤에서 액체 상으로 전이(융해)되는 특성 온도를 갖는다. 액체 상 이중층에서는 지질이 확산되어 막 표면을 가로질러 이동할 수 있지만, 젤 상 이중층의 지질은 이동성이 떨어진다.[30]지질 이중층의 상 거동은 인접한 지질 분자 사이의 반 데르 발스 힘 상호작용의 강도에 의해 크게 결정된다. 꼬리가 긴 지질은 상호작용 면적이 넓어 상호작용의 강도가 증가하고, 지질 이동성이 감소한다. 따라서 짧은 꼬리 지질은 긴 꼬리 지질보다 유동적이다.[13] 전이 온도는 지질 꼬리의 불포화 정도에 의해서도 영향을 받는다. 불포화 이중 결합은 알케인 사슬에 굴곡을 생성하여 지질 패킹을 방해하고, 이중층 내에 빈 공간을 만들어 유연성을 허용한다.[13] 포화 지방이 많은 버터는 실온에서 고체인 반면, 불포화 지방이 많은 식물성 기름은 액체이다.[31]

천연 막은 서로 다른 지질 분자의 복잡한 혼합물이다. 일부 성분이 특정 온도에서 액체이고 다른 성분이 젤 상에 있는 경우, 두 상은 공간적으로 분리되어 공존할 수 있다.[32] 이러한 상 분리는 막 구성 요소가 한 상으로 분할되어 국부적으로 농축되거나 활성화될 수 있기 때문에 생화학적 현상에서 중요하다.[32] 콜레스테롤은 이중층 투과성, 기계적 강도 및 생화학적 상호 작용을 조절하는 혼합 상 시스템의 중요한 구성 요소이다.[33]
3. 3. 표면 화학
지질 꼬리가 이중층의 상(phase) 행동을 주로 조절하는 반면, 이중층의 표면 화학을 결정하는 것은 머리 그룹이다. 대부분의 자연 이중층은 주로 인지질로 구성되지만, 스핑고지질 및 콜레스테롤과 같은 스테롤도 중요한 구성 요소이다.[34] 인지질 중에서 가장 흔한 머리 그룹은 포스파티딜콜린(PC)이며, 대부분의 포유류 세포에서 인지질의 약 절반을 차지한다.[113] 포스파티딜콜린은 쯔비터이온성 머리 그룹으로, 인산기에 음전하, 아민에 양전하를 띠지만, 이러한 국소 전하가 균형을 이루어 순전하는 전하는 없다.[35]다른 머리 그룹도 다양한 정도로 존재하며 포스파티딜세린(PS), 포스파티딜에탄올아민(PE), 포스파티딜글리세롤(PG)을 포함할 수 있다. 이러한 대체 머리 그룹은 종종 맥락에 따라 특정 생물학적 기능을 부여한다. 예를 들어, 적혈구의 세포 외막 표면에 PS가 존재한다는 것은 세포 아폽토시스의 지표이며,[36] 성장판 소포 내의 PS는 수산화인회석 결정의 핵형성 및 그에 따른 골 무기질화에 필요하다.[37][38] PC와 달리 다른 머리 그룹 중 일부는 순전하를 띠며, 이는 작은 분자와 이중층 간의 정전기적 상호작용을 변경할 수 있다.[39]
3. 4. 기계적 성질
지질 이중층은 액체나 고체의 일부 기계적 특성을 지닌 큰 구조이다. 면적 압축률 Ka, 굽힘률 Kb, 가장자리 에너지 등으로 설명할 수 있다. 고체 지질 이중층은 전단 탄성률을 갖지만, 유체 이중층의 전단 탄성률은 0이다.[76][77] 이러한 기계적 특성은 막 단백질과 작은 분자가 이중층에 삽입되는 능력, 기계적으로 활성화된 이온 채널의 기능에 영향을 미친다.[78] 또한 지질 이중층의 기계적 특성은 세포가 파열 없이 견딜 수 있는 응력 유형을 결정한다. 지질 이중층은 쉽게 구부러지지만, 대부분 파열 전까지 몇 퍼센트 이상 늘어나기 어렵다.[79]물 속에서 지질 꼬리의 소수성 인력은 지질 이중층을 유지하는 주요 힘이다. 이중층의 탄성률은 지질 분자가 서로 늘어날 때 물에 노출되는 추가 면적에 의해 주로 결정된다.[80] Ka는 삼투압에 따라 크게 변동하지만,[81] 꼬리 길이와 불포화도에는 약하게 변동한다.[13] 관련된 힘이 매우 작아 Ka를 실험적으로 결정하기는 어렵다. 대부분 정교한 현미경과 매우 민감한 측정 장비가 필요하다.[57][82]
Kb는 이중층을 구부리거나 굽히는 데 필요한 에너지의 척도이다. 굽힘률은 막을 고유한 곡률에서 다른 곡률로 변형하는 데 필요한 에너지로 정의된다. 고유 곡률은 머리 그룹과 꼬리 그룹 직경의 비율로 정의된다. 2개의 꼬리를 가진 PC 지질의 경우 이 비율은 거의 1이므로 고유 곡률은 거의 0이다. 특정 지질이 0에서 크게 벗어나면 이중층을 형성하지 않고 미셀 등의 다른 상을 형성한다.
는 이중층 가장자리를 물에 노출시키는 데 필요한 에너지의 척도이다. 이 에너지의 기원은 경계 지질의 일부가 물에 노출된다는 사실이지만, 정확한 방향은 알려져 있지 않다. 소수성 및 친수성 기공이 모두 공존할 수 있다는 증거가 있다.[84][85]

4. 생물학적 역할
## 격리 및 분획화
지질 이중층의 주요 역할은 수용액 구획을 주변 환경으로부터 분리하는 것이다. "자신"과 "비자신"을 구별하는 일종의 장벽이 없다면, 생물체나 생명의 개념을 정의하기조차 어렵다.[40] 이러한 지질 이중층은 세포 내부와 외부를 분리하고, 세포 내 세포 소기관을 구획화하여 생화학 반응의 효율성과 특이성을 높인다.
친수성 분자가 소수성 이중층 코어를 쉽게 통과할 수 없다는 사실에 기반하여 지질 이중층은 분할 능력을 가진다.[42] 핵, 미토콘드리아 및 엽록체는 두 개의 지질 이중층을 가지고 있으며, 다른 세포 내 구조물은 단일 지질 이중층(예: 세포막, 소포체, 골지체 및 리소좀)으로 둘러싸여 있다.[42] 원핵생물은 단 하나의 지질 이중층, 즉 세포막을 가지고 있다. 많은 원핵생물은 세포벽을 가지고 있지만, 세포벽은 지질이 아닌 단백질 또는 긴 사슬의 탄수화물로 구성된다. 반대로, 진핵생물은 세포 핵, 미토콘드리아, 리소좀 및 소포체를 포함한 다양한 세포 소기관을 가지고 있다.[45]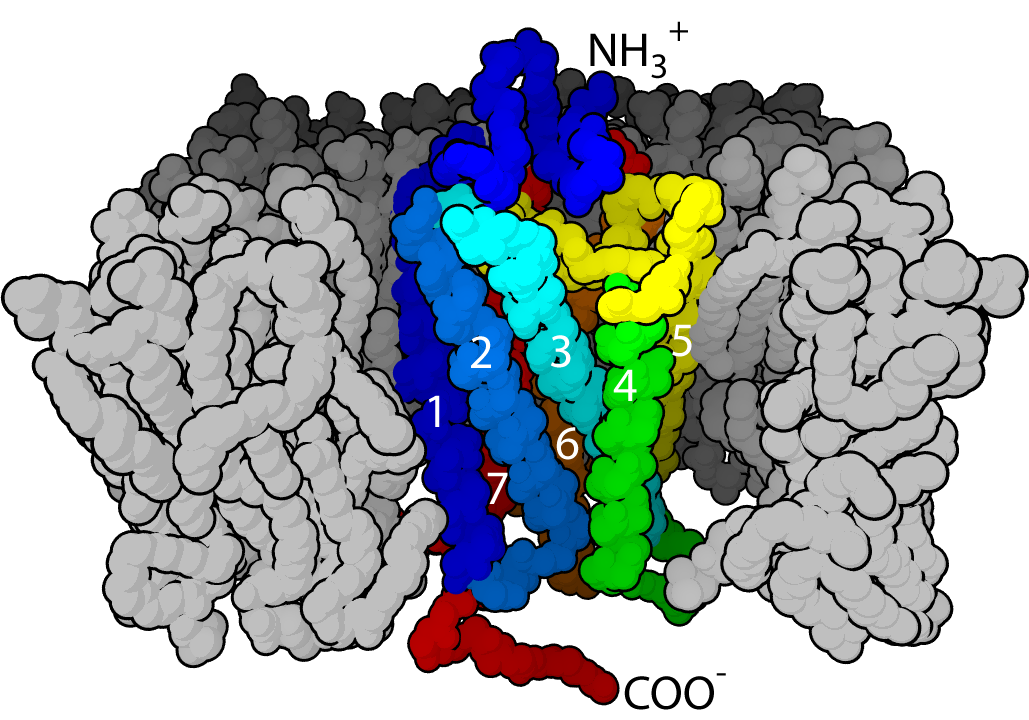
세포막은 주로 인지질이 틈 없이 배열된 층이 이중층을 형성하는 막 지질 이중층과 섬유상 단백질이 세포막을 뒷받침하여 지지하는 막 골격, 지질 이중층과 막 골격을 연결하여 유지하는 막 관통 단백질 및 앵커 단백질, 세포막을 관통하여 물질의 세포 내외 교환 역할을 수행하는 펌프, 캐리어, 채널이라고 불리는 막 관통 단백질과 정보 교환을 위한 수용체, 표면을 솜털처럼 덮어 세포 간 정보 전달이나 다른 세포와의 부착·분리에도 관련된 당쇄 등으로 이루어져 있다.
## 신호 전달
지질 이중층은 시냅스 전달에 관여하는데, 신경 임펄스가 뉴런의 끝에 도달하면 신경전달물질이 방출되어 인접한 뉴런으로 전달된다. 이 과정은 시냅스 소포가 지질 이중층 융합을 통해 세포막과 융합하고 내용물을 세포 외부로 방출하면서 가능해진다.
지질 이중층은 적분 막 단백질의 보금자리 역할을 하여 신호 전달에 관여한다. CD59 단백질은 세포를 "자신"으로 식별하여 면역 체계에 의한 파괴를 억제하며, HIV 바이러스는 숙주 막에서 이러한 단백질을 자신의 표면에 이식하여 면역 체계를 회피한다. G 단백질 결합 수용체(GPCR)는 세포 외부에서 세포 내부로 신호 이벤트를 전달하며, 모든 현대 의약품의 약 40%가 GPCR을 표적으로 한다.
지질 이중층은 포스파티딜세린 유발 탐식을 통해 신호 전달에 직접 참여할 수 있다. 프로그램된 세포 사멸 동안 스크램블라제는 포스파티딜세린 분포의 균형을 이루어 세포 외 이중층 표면에 포스파티딜세린을 표시하고, 이는 죽거나 죽어가는 세포를 제거하기 위한 탐식을 유발한다.
세포막은 막 지질 이중층, 막 골격, 막 관통 단백질, 앵커 단백질, 펌프, 캐리어, 채널, 수용체, 당쇄 등으로 구성된다. 지질 라프트는 다른 부분보다 두껍고 단단하며, 스핑고미엘린(SM)과 콜레스테롤 분자로 구성되어 분자 간 결합을 강화한다.[132][133] 라프트에는 막 관통 단백질, 수용체, 당지질 등이 존재하며 세포 기능에 관여한다.[132][133]
## 세포 간 상호작용
지질 이중층은 세포 부착, 세포 융합, 세포 인식 등 다양한 세포 간 상호작용에 관여한다. 예를 들어, 세포자멸사 과정에서 세포막 표면에 노출되는 포스파티딜세린은 대식세포에 의한 탐식 작용을 유도한다.
시냅스 전달에서 뉴런의 신경 임펄스는 신경전달물질의 방출을 통해 인접한 뉴런으로 전달되는데, 이는 시냅스 소포가 지질 이중층 융합을 통해 세포막과 융합하면서 가능해진다.
지질 이중층은 적분 막 단백질의 보금자리로서 신호 전달에 관여하기도 한다. CD59 단백질은 세포를 "자신"으로 식별하여 면역 체계에 의한 파괴를 억제하는데, HIV 바이러스는 숙주 막에서 이러한 단백질을 자체 표면에 이식하여 면역 체계를 회피한다. G 단백질 결합 수용체(GPCR)는 세포 외부에서 내부로 신호를 전달하는 막 단백질의 일종으로, 모든 현대 의약품의 약 40%가 GPCR을 표적으로 한다.
4. 1. 격리 및 분획화
지질 이중층의 주요 역할은 수용액 구획을 주변 환경으로부터 분리하는 것이다. "자신"과 "비자신"을 구별하는 일종의 장벽이 없다면, 생물체나 생명의 개념을 정의하기조차 어렵다.[40] 이러한 지질 이중층은 세포 내부와 외부를 분리하고, 세포 내 세포 소기관을 구획화하여 생화학 반응의 효율성과 특이성을 높인다.친수성 분자가 소수성 이중층 코어를 쉽게 통과할 수 없다는 사실에 기반하여 지질 이중층은 분할 능력을 가진다.[42] 핵, 미토콘드리아 및 엽록체는 두 개의 지질 이중층을 가지고 있으며, 다른 세포 내 구조물은 단일 지질 이중층(예: 세포막, 소포체, 골지체 및 리소좀)으로 둘러싸여 있다.[42] 원핵생물은 단 하나의 지질 이중층, 즉 세포막을 가지고 있다. 많은 원핵생물은 세포벽을 가지고 있지만, 세포벽은 지질이 아닌 단백질 또는 긴 사슬의 탄수화물로 구성된다. 반대로, 진핵생물은 세포 핵, 미토콘드리아, 리소좀 및 소포체를 포함한 다양한 세포 소기관을 가지고 있다.[45]
세포막은 주로 인지질이 틈 없이 배열된 층이 이중층을 형성하는 막 지질 이중층과 섬유상 단백질이 세포막을 뒷받침하여 지지하는 막 골격, 지질 이중층과 막 골격을 연결하여 유지하는 막 관통 단백질 및 앵커 단백질, 세포막을 관통하여 물질의 세포 내외 교환 역할을 수행하는 펌프, 캐리어, 채널이라고 불리는 막 관통 단백질과 정보 교환을 위한 수용체, 표면을 솜털처럼 덮어 세포 간 정보 전달이나 다른 세포와의 부착·분리에도 관련된 당쇄 등으로 이루어져 있다.
4. 2. 신호 전달
지질 이중층은 시냅스 전달에 관여하는데, 신경 임펄스가 뉴런의 끝에 도달하면 신경전달물질이 방출되어 인접한 뉴런으로 전달된다. 이 과정은 시냅스 소포가 지질 이중층 융합을 통해 세포막과 융합하고 내용물을 세포 외부로 방출하면서 가능해진다.지질 이중층은 적분 막 단백질의 보금자리 역할을 하여 신호 전달에 관여한다. CD59 단백질은 세포를 "자신"으로 식별하여 면역 체계에 의한 파괴를 억제하며, HIV 바이러스는 숙주 막에서 이러한 단백질을 자신의 표면에 이식하여 면역 체계를 회피한다. G 단백질 결합 수용체(GPCR)는 세포 외부에서 세포 내부로 신호 이벤트를 전달하며, 모든 현대 의약품의 약 40%가 GPCR을 표적으로 한다.
지질 이중층은 포스파티딜세린 유발 탐식을 통해 신호 전달에 직접 참여할 수 있다. 프로그램된 세포 사멸 동안 스크램블라제는 포스파티딜세린 분포의 균형을 이루어 세포 외 이중층 표면에 포스파티딜세린을 표시하고, 이는 죽거나 죽어가는 세포를 제거하기 위한 탐식을 유발한다.
세포막은 막 지질 이중층, 막 골격, 막 관통 단백질, 앵커 단백질, 펌프, 캐리어, 채널, 수용체, 당쇄 등으로 구성된다. 지질 라프트는 다른 부분보다 두껍고 단단하며, 스핑고미엘린(SM)과 콜레스테롤 분자로 구성되어 분자 간 결합을 강화한다.[132][133] 라프트에는 막 관통 단백질, 수용체, 당지질 등이 존재하며 세포 기능에 관여한다.[132][133]
4. 3. 세포 간 상호작용
지질 이중층은 세포 부착, 세포 융합, 세포 인식 등 다양한 세포 간 상호작용에 관여한다. 예를 들어, 세포자멸사 과정에서 세포막 표면에 노출되는 포스파티딜세린은 대식세포에 의한 탐식 작용을 유도한다.시냅스 전달에서 뉴런의 신경 임펄스는 신경전달물질의 방출을 통해 인접한 뉴런으로 전달되는데, 이는 시냅스 소포가 지질 이중층 융합을 통해 세포막과 융합하면서 가능해진다.
지질 이중층은 적분 막 단백질의 보금자리로서 신호 전달에 관여하기도 한다. CD59 단백질은 세포를 "자신"으로 식별하여 면역 체계에 의한 파괴를 억제하는데, HIV 바이러스는 숙주 막에서 이러한 단백질을 자체 표면에 이식하여 면역 체계를 회피한다. G 단백질 결합 수용체(GPCR)는 세포 외부에서 내부로 신호를 전달하는 막 단백질의 일종으로, 모든 현대 의약품의 약 40%가 GPCR을 표적으로 한다.
5. 막 수송
5. 1. 수동 수송
극성 분자는 지질 이중층의 탄화수소 코어에서 용해도가 낮아 이중층을 가로지르는 투과 계수가 낮다. 특히 전하를 띤 종은 중성 극성 분자보다 투과 계수가 더 낮다.[60] 음이온은 일반적으로 양이온보다 이중층을 더 빠르게 확산한다.[61][62] 이온과 비교하여 물 분자는 삼투압 팽윤에서 알 수 있듯이 이중층을 통해 비교적 큰 투과성을 갖는다.[63] 작고 전하를 띠지 않는 무극성 분자는 이온이나 물보다 수만 배 빠르게 지질 이중층을 통해 확산되며, 지방, 클로로포름, 에테르와 같은 유기 용매 모두에 적용된다. 극성 특성과 관계없이 큰 분자는 작은 분자보다 지질 이중층을 더 느리게 확산된다.[64]
5. 2. 능동 수송
이온 펌프는 ATP 가수분해와 같은 외부 에너지원을 이용하여 이온을 농도 기울기에 역행하여 더 높은 화학적 퍼텐셜 영역으로 이동시킨다.[65][66] Na+-K+ ATPase가 대표적인 예시이다. 이와 달리 이온 통로는 화학적 기울기를 만들지 않고, 이를 소모하여 신호를 보낸다. 전압 개폐 Na+ 통로는 신경 세포를 따라 활동 전위를 전달하게 해주는 대표적인 예시이다. 이온 통로는 특정한 트리거 또는 "게이팅" 메커니즘을 가지고 있어, 전기적 편향, 분자 작용제 결합, 혹은 근처 단백질의 입체 구조 변화를 통해 활성화될 수 있다.[67] 양성자 펌프를 통해 pH를 조절하는 것도 이온 펌프의 작용을 통한 것이다.[65][66]5. 3. 소포 수송
일부 분자 또는 입자는 너무 크거나 친수성이 커서 지질 이중층을 통과할 수 없다. 다른 분자는 이중층을 통과할 수 있지만 채널형 수송으로는 실용적이지 않을 정도로 대량으로 빠르게 수송해야 한다. 두 경우 모두, 이러한 유형의 화물은 융합 또는 소포의 출아를 통해 세포막을 가로질러 이동할 수 있다. 세포 내부에서 소포가 생성되어 원형질막과 융합하여 내용물을 세포 외 공간으로 방출할 때, 이 과정을 세포외유출이라고 한다. 반대 과정에서는 세포막의 한 영역이 안으로 옴푹 들어가 결국 잘려나가 세포 외 유체의 일부를 둘러싸 세포 안으로 수송한다. 세포내이입과 세포외유출은 기능을 위해 매우 다른 분자 기계 장치에 의존하지만, 두 과정은 밀접하게 연결되어 있으며 서로 없이는 작동할 수 없다. 이러한 상호 의존성의 주요 메커니즘은 관련된 많은 양의 지질 물질이다.[68] 일반적인 세포에서 전체 원형질막과 동일한 면적의 이중층은 약 30분 안에 세포내이입/세포외유출 주기를 거친다.[69]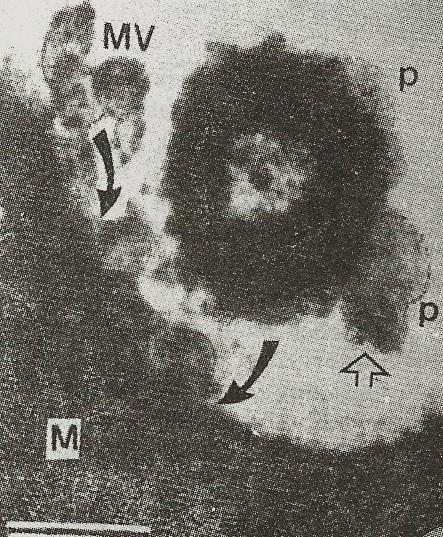
막 소포 세포외유출은 진핵 세포의 특권으로 간주되었으나,[70] 그람 음성 미생물이 방출하는 세균 외부 막 소포로 알려진 나노소포가 세균 신호 분자를 숙주 또는 표적 세포로 이동시켜 여러 과정을 수행한다는 사실이 밝혀지면서 이 통념은 깨졌다. 예를 들어, ''숙주 세포 침입''[72] 및 미생물-환경 상호 작용과 같은 과정이 있다.[73]
6. 연구 방법
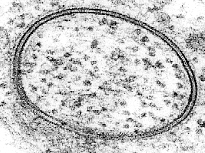
지질 이중층은 매우 얇고 깨지기 쉬워서 연구하기 어려운 구조이다.[51] 이러한 한계를 극복하기 위해 그 구조와 기능을 조사할 수 있는 기술들이 개발되었다.[48][51][53]
- * 전기 생리학적 측정
전기적 측정은 이중층의 중요한 기능, 즉 용액 내 이온의 분리 및 흐름 방지 능력을 특성화하는 간단한 방법이다. 이중층에 전압을 가하고 그에 따른 전류를 측정하여 이중층의 저항을 결정한다. 소수성 코어가 하전된 물질에 투과성이 없기 때문에 이 저항은 일반적으로 매우 높다(108 Ohm-cm2 이상).[48] 몇 나노미터 크기의 구멍이 존재하더라도 전류가 급격히 증가한다.[49] 이 시스템의 민감도는 단일 이온 채널의 활동조차도 감지할 수 있을 정도이다.[50] 패치 클램프 기법은 막 전위 변화에 따른 이온 흐름을 연구하는데 사용될수 있다.
- * 형광 현미경
지질 이중층은 매우 얇아 일반적인 현미경으로는 관찰이 어렵기 때문에, 연구자들은 주로 형광 현미경을 사용한다.[51] 시료에 특정 파장의 빛을 쬐어 다른 파장의 빛을 방출하는 형광 분자를 관찰하는 방식으로, 자연 상태의 지질 이중층은 형광을 띠지 않으므로 형광 염료를 부착한 분자를 이용한다.[51]
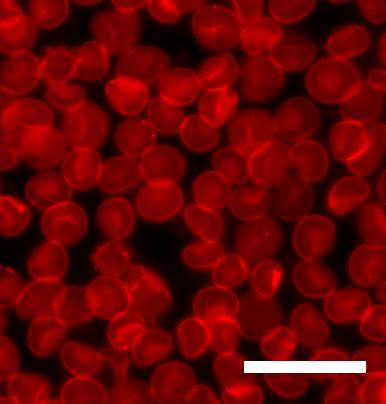
- * 전자 현미경
전자 현미경은 높은 해상도의 이미지를 제공한다.[52] 전자 현미경에서는 초점을 맞춘 전자 빔이 빛의 빔 대신 표본과 상호 작용한다.[52] 급속 냉동 기술과 함께 전자 현미경은 세포간 및 세포내 수송의 메커니즘을 연구하는 데 사용되었다.[52] 예를 들어 세포외유출 소포가 시냅스에서 화학 물질 방출의 수단임을 입증하는 데 사용되었다.[52]
- * 원자 힘 현미경 (AFM)
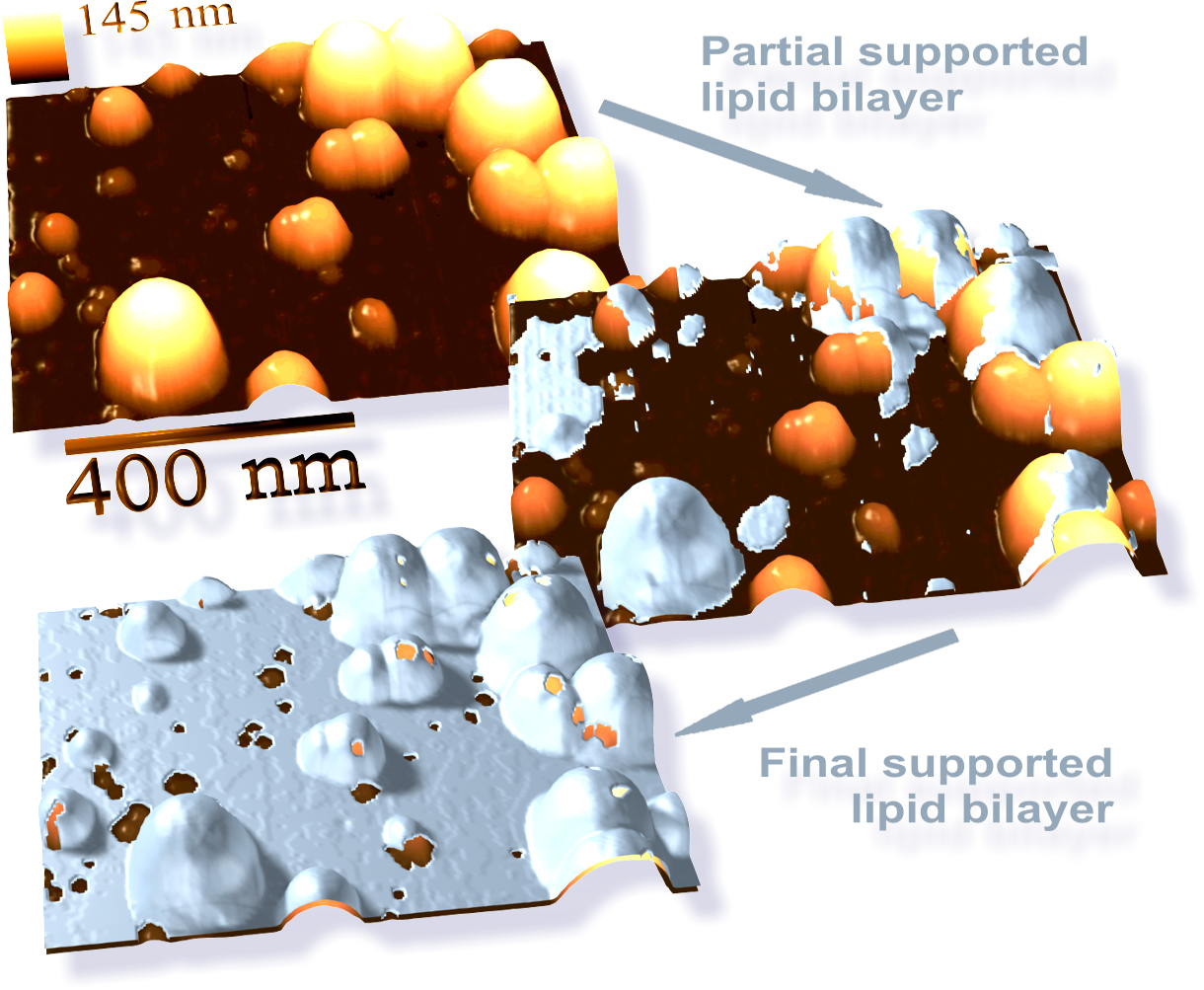
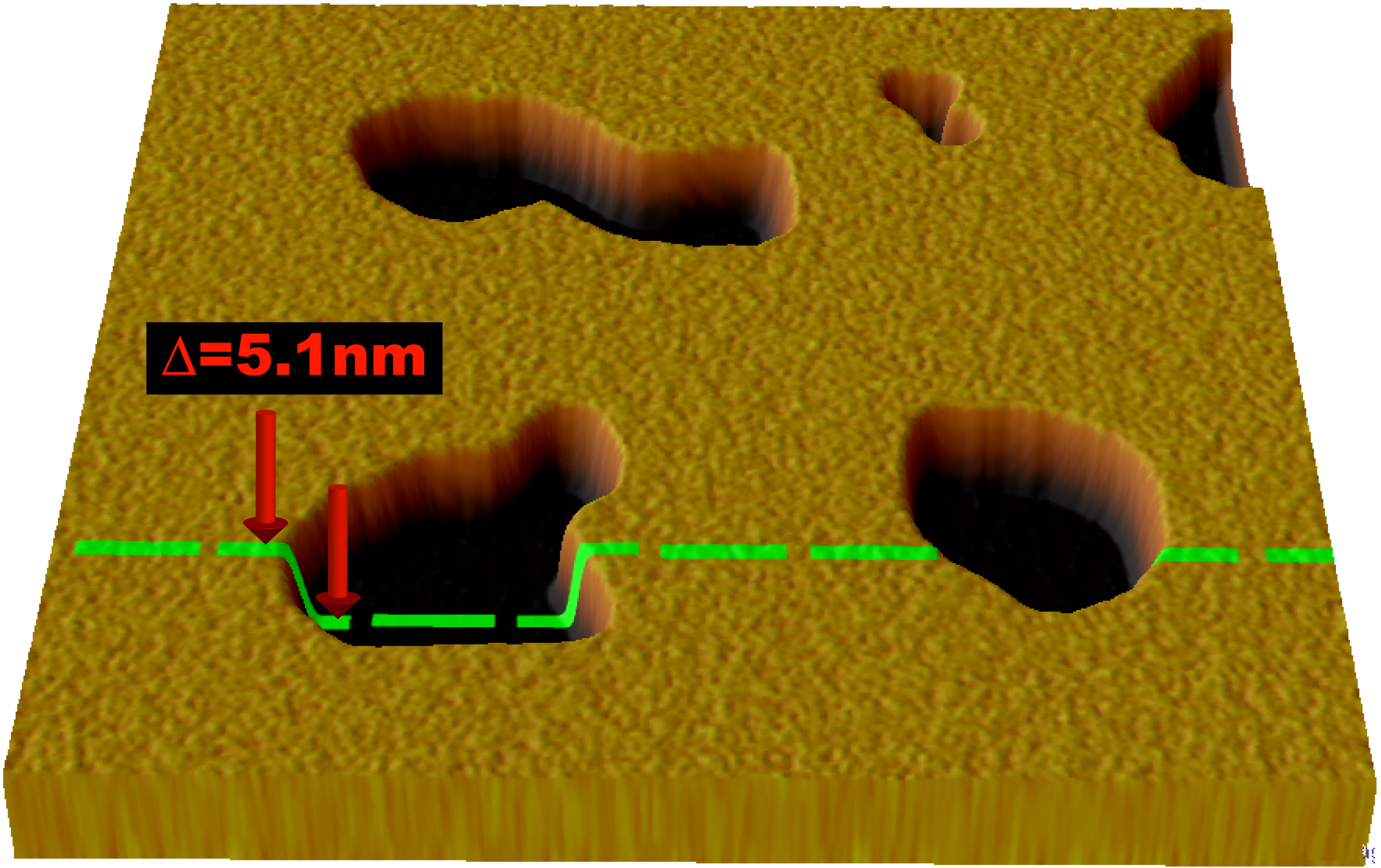
원자 힘 현미경(AFM)은 지질 이중층 연구에 사용되는 새로운 방법이다. 빛이나 입자 빔을 사용하는 대신, 매우 작고 뾰족한 팁이 레코드 플레이어 바늘처럼 이중층과 물리적 접촉을 하여 표면을 스캔한다. AFM은 나노미터 해상도로 실온 및 물이나 생리적 완충액 조건에서도 이미징할 수 있어 자연적인 이중층 거동 연구에 적합하다.[54]
AFM은 막 관통 기공(구멍)의 형성[54] 및 지지된 이중층의 상 전이[55] 등 동적 이중층 거동을 조사하는 데 활용된다. 지질의 형광 또는 동위 원소 표지를 필요로 하지 않아, 프로브 팁이 이중층 표면과 기계적으로 상호 작용하기 때문에 동일한 스캔으로 지질과 관련된 단백질을 모두 이미징할 수 있으며, 때로는 단일 분자 해상도까지 가능하다.[54][56] AFM은 또한 지질 이중층의 기계적 특성을 탐구할 수 있다.[57]
- * 분자 동역학 시뮬레이션
지질 이중층은 많은 자유도를 가진 복잡한 분자 시스템이다. 따라서 막의 원자 시뮬레이션, 특히 그 특성에 대한 ab initio 계산은 어렵고 계산 비용이 많이 든다. 최근에는 지질 막의 쌍극자 모멘트 및 사중극자 모멘트를 추정하기 위해 양자 화학 계산이 성공적으로 수행되었다.[59]
6. 1. 전기 생리학적 측정
전기적 측정은 이중층의 중요한 기능, 즉 용액 내 이온의 분리 및 흐름 방지 능력을 특성화하는 간단한 방법이다. 이중층에 전압을 가하고 그에 따른 전류를 측정하여 이중층의 저항을 결정한다. 소수성 코어가 하전된 물질에 투과성이 없기 때문에 이 저항은 일반적으로 매우 높다(108 Ohm-cm2 이상).[48] 몇 나노미터 크기의 구멍이 존재하더라도 전류가 급격히 증가한다.[49] 이 시스템의 민감도는 단일 이온 채널의 활동조차도 감지할 수 있을 정도이다.[50] 패치 클램프 기법은 막 전위 변화에 따른 이온 흐름을 연구하는데 사용될수 있다.6. 2. 형광 현미경
지질 이중층은 매우 얇아 일반적인 현미경으로는 관찰이 어렵기 때문에, 연구자들은 주로 형광 현미경을 사용한다.[51] 시료에 특정 파장의 빛을 쬐어 다른 파장의 빛을 방출하는 형광 분자를 관찰하는 방식으로, 자연 상태의 지질 이중층은 형광을 띠지 않으므로 형광 염료를 부착한 분자를 이용한다.[51] 이 방법은 수백 나노미터의 분해능 한계를 가지는데, 이는 지질 이중층의 두께보다 훨씬 크다.[51]6. 3. 전자 현미경
전자 현미경은 높은 해상도의 이미지를 제공한다.[52] 전자 현미경에서는 초점을 맞춘 전자 빔이 빛의 빔 대신 표본과 상호 작용한다.[52] 급속 냉동 기술과 함께 전자 현미경은 세포간 및 세포내 수송의 메커니즘을 연구하는 데 사용되었다.[52] 예를 들어 세포외유출 소포가 시냅스에서 화학 물질 방출의 수단임을 입증하는 데 사용되었다.[52]6. 4. 원자 힘 현미경 (AFM)
원자 힘 현미경(AFM)은 지질 이중층 연구에 사용되는 새로운 방법이다. 빛이나 입자 빔을 사용하는 대신, 매우 작고 뾰족한 팁이 레코드 플레이어 바늘처럼 이중층과 물리적 접촉을 하여 표면을 스캔한다. AFM은 나노미터 해상도로 실온 및 물이나 생리적 완충액 조건에서도 이미징할 수 있어 자연적인 이중층 거동 연구에 적합하다.[54]
AFM은 막 관통 기공(구멍)의 형성[54] 및 지지된 이중층의 상 전이[55] 등 동적 이중층 거동을 조사하는 데 활용된다. 지질의 형광 또는 동위 원소 표지를 필요로 하지 않아, 프로브 팁이 이중층 표면과 기계적으로 상호 작용하기 때문에 동일한 스캔으로 지질과 관련된 단백질을 모두 이미징할 수 있으며, 때로는 단일 분자 해상도까지 가능하다.[54][56] AFM은 또한 지질 이중층의 기계적 특성을 탐구할 수 있다.[57]
6. 5. 분자 동역학 시뮬레이션
지질 이중층은 많은 자유도를 가진 복잡한 분자 시스템이다. 따라서 막의 원자 시뮬레이션, 특히 그 특성에 대한 ab initio 계산은 어렵고 계산 비용이 많이 든다. 최근에는 지질 막의 쌍극자 모멘트 및 사중극자 모멘트를 추정하기 위해 양자 화학 계산이 성공적으로 수행되었다.[59]7. 모델 시스템
지질 이중층은 연구자들이 자연 이중층으로는 할 수 없는 실험을 수행할 수 있도록 실험실에서 인공적으로 만들 수 있다.[95] 또한, 인공 생명체의 경계를 정의하기 위해 인공 세포 분야에서 사용할 수도 있다.[95] 이러한 인공 시스템을 모델 지질 이중층이라고 한다.[95] 다양한 종류의 모델 이중층이 있으며, 각각 실험적인 장단점을 가지고 있다.[95] 인공 지질 또는 천연 지질로 만들 수 있다.[95] 가장 일반적인 모델 시스템에는 블랙 지질 막(BLM), 지지 지질 이중층(SLB), 소포, 방울 계면 이중층(DIB) 등이 있다.[95]
7. 1. 블랙 지질막 (BLM)
7. 2. 지지 지질 이중층 (SLB)
7. 3. 리포솜
8. 응용 분야
리포솜을 이용한 약물 전달은 지질 이중층의 가장 성공적인 상업적 응용 분야이다.[96] ("리포솜"이라는 용어는 본질적으로 "소포"와 동의어이지만, 소포는 구조에 대한 일반적인 용어인 반면, 리포솜은 인공 소포에만 해당하며 자연 소포에는 해당하지 않는다.) 리포솜 약물 전달의 기본 아이디어는 약물을 리포솜 내부의 용액에 캡슐화한 다음 환자에게 주입하는 것이다. 이러한 약물 탑재 리포솜은 표적 부위에 결합하여 파열될 때까지 시스템을 통해 이동하여 약물을 방출한다. 이론적으로 리포솜은 거의 모든 친수성 약물을 격리할 수 있고, 특정 조직을 표적으로 삼기 위해 분자와 접목할 수 있으며, 신체가 지질을 대사하는 생화학적 경로를 가지고 있기 때문에 비교적 독성이 없기 때문에 이상적인 약물 전달 시스템이 되어야 한다.[96]
1세대 약물 전달 리포솜은 단순한 지질 조성을 가지고 있었고 몇 가지 제한 사항에 시달렸다. 신장 제거와 식세포 작용 모두로 인해 혈류 내 순환이 극도로 제한되었다. 유동성, 표면 전하 밀도 및 표면 수화를 조절하기 위해 지질 조성을 개선한 결과 혈청에서 더 적은 단백질을 흡착하는 소포가 생성되었으며, 따라서 면역 체계에 의해 덜 쉽게 인식되었다.[97] 이 분야에서 가장 중요한 발전은 폴리에틸렌 글리콜 (PEG)을 리포솜 표면에 접목하여 면역 또는 신장 제거 없이 오랜 시간 동안 순환하는 "스텔스" 소포를 생산하는 것이었다.[98]
초기 스텔스 리포솜은 종양 조직을 수동적으로 표적화했다. 종양은 빠르고 제어되지 않는 혈관 신생을 유도하기 때문에 특히 "누출"이 심하고 리포솜이 정상 조직보다 훨씬 높은 속도로 혈류에서 빠져나가게 한다.[99] 최근에는 특정 세포 또는 조직 유형에 능동적으로 결합하기를 바라며 항체 또는 기타 분자 표지자를 리포솜 표면에 접목하는 연구가 진행되었다.[100] 이러한 접근 방식의 몇 가지 예가 이미 임상 시험 중에 있다.[101]
지질 이중층의 또 다른 잠재적 응용 분야는 바이오센서 분야이다. 지질 이중층은 세포 내부와 외부 사이의 장벽이므로 광범위한 신호 전달의 현장이기도 하다. 수년 동안 연구자들은 임상 진단 또는 생물 테러 감지를 위한 이중층 기반 장치를 개발하기 위해 이러한 잠재력을 활용하려고 노력해 왔다. 이 분야의 진전은 더디게 진행되었으며, 몇몇 회사에서 자동화된 지질 기반 감지 시스템을 개발했지만 여전히 연구 커뮤니티를 대상으로 하고 있다. 여기에는 결합 역학 연구에 지질 이중층을 활용하기 위한 일회용 칩을 제공하는 Biacore (현재 GE 헬스케어 생명과학)와 평면 패치 클램프 시스템을 개발한 Nanion Inc.가 포함된다.[102][103]
위에 설명된 지지 지질 이중층 (SLB)은 약물의 투과성을 측정하는 스크리닝 기술로 상업적 성공을 거두었다. 이 평행 인공 막 투과성 분석 (PAMPA) 기술은 Caco-2 배양,[104][105] 위장관,[106] 혈액-뇌 장벽[107] 및 피부[108]와 매우 높은 상관 관계가 있는 것으로 밝혀진 특정 지질 혼합물을 가로지르는 투과성을 측정한다.
8. 1. 약물 전달
리포솜을 이용한 약물 전달은 지질 이중층의 가장 성공적인 상업적 응용 분야이다.[96] 리포솜 약물 전달의 기본 아이디어는 약물을 리포솜 내부의 용액에 캡슐화한 다음 환자에게 주입하는 것이다. 이러한 약물 탑재 리포솜은 표적 부위에 결합하여 파열될 때까지 시스템을 통해 이동하여 약물을 방출한다. 이론적으로 리포솜은 거의 모든 친수성 약물을 격리할 수 있고, 특정 조직을 표적으로 삼기 위해 분자와 접목할 수 있으며, 신체가 지질을 대사하는 생화학적 경로를 가지고 있기 때문에 비교적 독성이 없기 때문에 이상적인 약물 전달 시스템이 되어야 한다.[96]1세대 약물 전달 리포솜은 단순한 지질 조성을 가지고 있었고 신장 제거와 식세포 작용으로 인해 혈류 내 순환이 극도로 제한되었다.[96] 지질 조성을 개선하여 혈청에서 더 적은 단백질을 흡착하는 소포가 생성되었으며, 면역 체계에 의해 덜 쉽게 인식되었다.[97] 폴리에틸렌 글리콜 (PEG)을 리포솜 표면에 접목하여 면역 또는 신장 제거 없이 오랜 시간 동안 순환하는 "스텔스" 소포를 생산하는 것이 이 분야에서 가장 중요한 발전이었다.[98]
초기 스텔스 리포솜은 종양 조직을 수동적으로 표적화했다. 종양은 빠르고 제어되지 않는 혈관 신생을 유도하기 때문에 리포솜이 정상 조직보다 훨씬 높은 속도로 혈류에서 빠져나가게 한다.[99] 최근에는 항체 또는 기타 분자 표지자를 리포솜 표면에 접목하여 특정 세포 또는 조직 유형에 능동적으로 결합하도록 하는 연구가 진행되고 있다.[100] 이러한 접근 방식의 몇 가지 예가 이미 임상 시험 중에 있다.[101]
8. 2. 바이오센서
지질 이중층은 세포 내부와 외부 사이의 장벽이자 광범위한 신호 전달의 현장이기 때문에, 이를 활용하여 임상 진단이나 생물 테러 감지를 위한 바이오센서 개발이 시도되고 있다.[102] 하지만 이 분야의 진전은 더디게 진행되었으며, 자동화된 지질 기반 감지 시스템은 주로 연구용으로 활용되고 있다. Biacore (현재 GE 헬스케어 생명과학)는 결합 역학 연구에 지질 이중층을 활용하기 위한 일회용 칩을 제공하며,[102] Nanion Inc.는 평면 패치 클램프 시스템을 개발했다.[103] 지지 지질 이중층(SLB)은 약물 투과성 측정 스크리닝 기술로 상업적 성공을 거두었는데, 평행 인공 막 투과성 분석(PAMPA) 기술은 Caco-2 배양,[104][105] 위장관,[106] 혈액-뇌 장벽[107] 및 피부[108]를 가로지르는 투과성을 측정하는 데 사용된다.8. 3. 인공 세포
지질 이중층은 인공 세포를 만드는 데 사용될 수 있다.[96] 인공 세포는 생체 기능을 모방하거나 새로운 기능을 갖도록 설계될 수 있다. 지질 이중층의 상업적 응용분야는 리포솜을 이용한 약물 전달이며, 특히 암 치료에 사용된다.[96] 리포솜은 약물을 캡슐화하여 환자에게 주입하고, 표적 부위에 결합하여 파열될 때 약물을 방출하는 원리로 작동한다.[96] 이론적으로 리포솜은 친수성 약물 격리, 특정 조직 표적화, 낮은 독성 등의 장점을 가지는 이상적인 약물 전달 시스템이다.[96]초기 리포솜은 신장 제거와 식세포 작용으로 인해 혈류 내 순환이 제한되었다.[97] 이후 지질 조성을 개선하여 면역 체계에 덜 인식되는 소포를 생성하였고, 폴리에틸렌 글리콜(PEG)을 리포솜 표면에 접목하여 "스텔스" 소포를 생산하여 순환 시간을 늘렸다.[98] 초기 스텔스 리포솜은 종양 조직을 수동적으로 표적화했는데, 이는 종양이 빠르고 제어되지 않는 혈관 신생을 유도하여 리포솜이 혈류에서 더 빨리 빠져나가기 때문이다.[99] 최근에는 항체나 분자 표지자를 리포솜 표면에 접목하여 특정 세포나 조직에 능동적으로 결합하는 연구가 진행 중이며, 일부는 임상 시험 단계에 있다.[100][101]
지질 이중층은 바이오센서 분야에도 응용될 수 있다.[102] 지질 이중층은 세포 내외부 장벽이자 신호 전달 현장이므로, 이를 활용하여 임상 진단이나 생물 테러 감지를 위한 장치를 개발하려는 연구가 진행되어 왔다. Biacore와 Nanion Inc. 등이 관련 시스템을 개발했지만, 주로 연구용으로 활용되고 있다.[102][103]
지지 지질 이중층(SLB)은 약물 투과성 측정 스크리닝 기술로 상업적 성공을 거두었다.[104] 평행 인공 막 투과성 분석(PAMPA) 기술은 Caco-2 배양,[104][105] 위장관,[106] 혈액-뇌 장벽[107] 및 피부[108] 투과성과 높은 상관 관계를 보인다.
9. 역사
20세기 초, 과학자들은 세포가 얇은 기름과 같은 장벽으로 둘러싸여 있다고 믿었지만, 이 막의 구조는 알려지지 않았다.[109] 1925년, 휴고 프릭케는 축전 용량을 적혈구 용액에서 측정하여 세포막의 두께가 3.3 nm임을 알아냈으나, 세포막이 단일 분자층이라는 잘못된 해석을 내렸다.[110] 같은 해, 에베르트 호르터 교수와 F. 그린델은 적혈구 지질을 랭뮤어-블로젯 트로프에서 단일층으로 펼쳐놓고 그 면적과 세포 표면적을 비교하여 2:1의 비율을 발견, 세포막이 지질 이중층이라는 결론을 내렸다.[112] 비록 이 실험에는 몇 가지 오류와 잘못된 가정이 있었지만, 우연히 상쇄되어 올바른 결론을 도출할 수 있었다.[113]
1950년대 후반, 전자 현미경을 통해 지질 이중층 이론이 확인되었다. J. 데이비드 로버트슨은 전자 현미경 연구를 통해 두 개의 어두운 전자 밀도가 높은 띠가 두 개의 마주보는 지질 단일층의 머리 그룹과 관련된 단백질이라고 주장하며 "단위 막" 개념을 제시, 이는 모든 세포막과 세포 소기관 막에 이중층 구조가 보편적으로 적용됨을 최초로 보여주었다.[115][116]
이와 비슷한 시기에, 모델 막 개발은 지질 이중층이 단백질 없이도 안정적인 구조임을 확인시켜 주었다. 뮐러와 루딘은 유기 용매에 지질 용액을 칠해 인공 이중층을 만들었고, 이것이 측면 유동성, 높은 전기 저항, 자가 치유 능력을 가짐을 확인했다.[117] 몇 년 후, 알렉 뱅엄은 건조된 지질 시료를 물에 노출시키는 것만으로도 지질 소포 형태의 이중층이 자발적으로 형성됨을 보였다.[118] 1977년에는 구니타케와 오카하타가 단일 유기 화합물을 사용하여 완전 합성 이중층 막을 제조하여, 이중층 막이 분자간 힘에 의해 조립됨을 입증했다.[119]
참조
[1]
서적
Permeability of Biological Membranes
https://books.google[...]
Springer
[2]
논문
Bilayer Thickness and Membrane Protein Function: An Energetic Perspective
2007-06
[3]
논문
Phospholipid signaling
1995-01-27
[4]
논문
From Self-Assembled Vesicles to Protocells
2010-07
[5]
웹인용
The Journal of Chemical Physics
http://jcp.aip.org/r[...]
2012-05-17
[6]
논문
Lipid bilayer thickness varies linearly with acyl chain length in fluid phosphatidylcholine vesicles
1983-05
[7]
논문
Neutron Diffraction Studies on the Location of Water in Lecithin Bilayer Model Membranes
1975-01
[8]
논문
Physical studies of cell surface and cell membrane structure. Deuterium nuclear magnetic resonance studies of N-palmitoylglucosylceramide (cerebroside) head group structure
1982-06-22
[9]
논문
Structure of lipid bilayers
2000-11
[10]
논문
Outer Membrane Vesicles of Gram-Negative Bacteria: An Outlook on Biogenesis
[11]
논문
Polarity and permeation profiles in lipid membranes
2001-07
[12]
논문
Membrane water-penetration profiles from spin labels
2002-12
[13]
논문
Effect of chain length and unsaturation on elasticity of lipid bilayers
2000-07
[14]
논문
The volume change in lipid bilayer lamellae at the crystalline-liquid crystalline phase transition
[15]
논문
Asymmetrical Lipid Bilayer Structure for Biological Membranes
1972-03-01
[16]
논문
The asymmetric distribution of phospholipids in the human red cell membrane. A combined study using phospholipases and freeze-etch electron microscopy
1973-10
[17]
논문
Investigating lipid headgroup composition within epithelial membranes: a systematic review
http://xlink.rsc.org[...]
2021
[18]
논문
Lipid topogenesis
http://www.jlr.org/c[...]
1981-03-01
[19]
논문
Membrane structure: some general principles
1973-08
[20]
논문
Rapid transmembrane movement of newly synthesized phospholipids during membrane assembly
1977-05
[21]
논문
Inside-outside transitions of phospholipids in vesicle membranes
1971-03
[22]
논문
Determination of molecular asymmetry in the phosphatidylethanolamine surface distribution in mixed phospholipid vesicles
1974-07
[23]
논문
Measuring lipid asymmetry in planar supported bilayers by fluorescence interference contrast microscopy
2005-02
[24]
논문
Formation of supported planar bilayers by fusion of vesicles to supported phospholipid monolayers
1992-01
[25]
논문
Lipid asymmetry in DLPC/DSPC-supported lipid bilayers: a combined AFM and fluorescence microscopy study
2006-01
[26]
논문
Effective Parameters Controlling Sterol Transfer: A Time-Resolved Small-Angle Neutron Scattering Study
https://pubmed.ncbi.[...]
2022-10
[27]
논문
Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes
2011-07-20
[28]
논문
Transbilayer coupling of obstructed lipid diffusion in polymer-tethered phospholipid bilayers
https://pubs.rsc.org[...]
2008-08-12
[29]
논문
Domain Registration in Raft-Mimicking Lipid Mixtures Studied Using Polymer-Tethered Lipid Bilayers
2007-02-15
[30]
서적
Random walks in biology
Princeton University Press
[31]
웹사이트
Fats and oils
https://www.heartuk.[...]
2024-12-01
[32]
논문
Partitioning of Thy-1, GM1, and cross-linked phospholipid analogs into lipid rafts reconstituted in supported model membrane monolayers
2001-09
[33]
서적
Life: The Science of Biology
Freeman
[34]
서적
Molecular Biology of the Cell
Garland Science
2017
[35]
논문
Phosphorylcholine-Based Zwitterionic Biocompatible Thermogel
2015-12-14
[36]
논문
The role of phosphatidylserine in recognition of apoptotic cells by phagocytes
1998-07
[37]
논문
The role of matrix vesicles in growth plate development and biomineralization
http://www.bioscienc[...]
2005-01
[38]
논문
Calcium phosphate precipitation in aqueous suspensions of phosphatidylserine-containing anionic liposomes
1987-01
[39]
논문
Binding of peptides with basic residues to membranes containing acidic phospholipids
1991-07
[40]
서적
Brock biology of microorganisms
https://archive.org/[...]
Prentice Hall
[41]
논문
Primeval cells: possible energy-generating and cell-division mechanisms
[42]
웹사이트
5.1 Cell Membrane Structure {{!}} Life Science {{!}} University of Tokyo
http://csls-text.c.u[...]
2012-11-10
[43]
서적
Fundamentals of Human Neuropsychology
Worth
[44]
논문
An ENSEMBLE machine learning approach for the prediction of all-alpha membrane proteins
[45]
서적
Molecular biology of the cell
Garland Science
[46]
논문
It's A GPCR World
[47]
논문
Exposure of phosphatidylserine on the surface of apoptotic lymphocytes triggers specific recognition and removal by macrophages.
http://dx.doi.org/10[...]
1992-04-01
[48]
논문
Formation of bimolecular membranes from lipid monolayers and a study of their electrical properties
1972-12
[49]
논문
Voltage-induced nonconductive pre-pores and metastable single pores in unmodified planar lipid bilayer
2001-04
[50]
논문
Single-channel currents recorded from membrane of denervated frog muscle fibres
http://nbn-resolving[...]
1976-04
[51]
서적
Methods in Membrane Lipids
Humana Press
2007
[52]
논문
Synaptic vesicle exocytosis captured by quick freezing and correlated with quantal transmitter release
1979-05
[53]
논문
Modeling of 31P-NMR spectra of magnetically oriented phospholipid liposomes: A new analytical solution
2006-06
[54]
논문
Interaction of Nanoparticles with Lipid Membrane
[55]
논문
Lipid membrane phase behavior elucidated in real time by controlled environment atomic force microscopy
https://zenodo.org/r[...]
[56]
논문
Characterization of lipid bilayers and protein assemblies supported on rough surfaces by atomic force microscopy
[57]
논문
Mechanical properties of pore-spanning lipid bilayers probed by atomic force microscopy
2006-07
[58]
논문
Dual-Polarization Interferometry: A Novel Technique To Light up the Nanomolecular World
2015-01-14
[59]
웹사이트
The Journal of Chemical Physics
http://jcp.aip.org/r[...]
2012-05-17
[60]
논문
Permeability of membranes to amino acids and modified amino acids: mechanisms involved in translocation
[61]
논문
Ion permeability of phospholipid bilayers
1972-10
[62]
논문
Phospholipid model membranes. II. Permeability properties of hydrated liquid crystals
1967-09
[63]
논문
Permeation of protons, potassium ions, and small polar molecules through phospholipid bilayers as a function of membrane thickness
1996-01
[64]
논문
The relationship between permeant size and permeability in lipid bilayer membranes
1994-06
[65]
논문
Modeling and simulation of ion channels
2012-12
[66]
서적
Neuroscience
Sinauer Associates
2001
[67]
논문
Principles of selective ion transport in channels and pumps
2005-12
[68]
논문
Temporal and spatial coordination of exocytosis and endocytosis
2003-02
[69]
논문
Membrane flow during pinocytosis. A stereologic analysis
1976-03
[70]
간행물
'Exocytosis in prokaryotes' and its role in ''salmonella'' invasion
https://www.research[...]
1999
[71]
간행물
Electron microscope studies of surface pili and vesicles of ''Salmonella'' 3,10:r:- organisms
https://www.research[...]
1993
[72]
간행물
Discovery of vesicular exocytosis in prokaryotes and its role in ''Salmonella'' invasion
https://www.research[...]
1998
[73]
논문
Exocytosis from gram negative bacteria for ''Salmonella'' invasion of chicken ileal epithelium
https://www.research[...]
[74]
논문
Gene transfer into mouse lyoma cells by electroporation in high electric fields
[75]
논문
Laboratory-scale evidence for lightning-mediated gene transfer in soil
2001-08
[76]
논문
Ion channels: gate expectations
2004-07
[77]
논문
Roles of Bilayer Material Properties in Function and Distribution of Membrane Proteins
[78]
논문
Bilayer-dependent inhibition of mechanosensitive channels by neuroactive peptide enantiomers
2004-07
[79]
논문
Mechanical properties of vesicles. II. A model for osmotic swelling and lysis
1993-02
[80]
서적
Mechanics of the cell
Cambridge University Press
[81]
논문
The elasticity of synthetic phospholipid vesicles obtained by photon correlation spectroscopy
1991-06
[82]
논문
Dynamic tension spectroscopy and strength of biomembranes
2003-10
[83]
간행물
Destabilisation of lamellar dispersion of ''thylakoid'' membrane lipids by sucrose
https://www.research[...]
1994
[84]
논문
Theory of electroporation: A review
[85]
논문
The effects of intra-membrane viscosity on lipid membrane morphology: complete analytical solution
2018
[86]
논문
Membrane fusion
1999
[87]
논문
Molecular mechanisms of calcium-induced membrane fusion
1990-04
[88]
논문
Divalent cation induced fusion and lipid lateral segregation in phosphatidylcholine-phosphatidic acid vesicles
1986-11
[89]
논문
On the theory of membrane fusion. The stalk mechanism
1984-10
[90]
논문
Protein-lipid interplay in fusion and fission of biological membranes
https://zenodo.org/r[...]
[91]
서적
Nano and Molecular Electronics Handbook
https://archive.org/[...]
CRC Press
[92]
논문
SNARE-mediated membrane fusion
2001-02
[93]
논문
Continuous cultures of fused cells secreting antibody of predefined specificity
1975-08
[94]
서적
Electroporation and electrofusion in cell biology
Plenum Press
[95]
논문
Artificial cell mimics as simplified models for the study of cell biology
2017-07
[96]
논문
Stealth liposomes: review of the basic science, rationale, and clinical applications, existing and potential
[97]
논문
Association of blood proteins with large unilamellar liposomes in vivo. Relation to circulation lifetimes
1992-09-15
[98]
논문
Stealth liposomes: from theory to product
[99]
논문
Mechanism of tumor-targeted delivery of macromolecular drugs, including the EPR effect in solid tumor and clinical overview of the prototype polymeric drug SMANCS
2001-07
[100]
논문
Cellular trafficking and cytotoxicity of anti-CD19-targeted liposomal doxorubicin in B lymphoma cells
[101]
논문
Phase I and pharmacokinetic study of MCC-465, a doxorubicin (DXR) encapsulated in PEG immunoliposome, in patients with metastatic stomach cancer
2004-03
[102]
웹사이트
Biacore Inc.
http://www.gelifesci[...]
[103]
웹사이트
Nanion Technologies. Automated Patch Clamp
http://www.nanion.de[...]
2010-03-31
[104]
논문
PAMPA--a drug absorption in vitro model 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones
[105]
논문
Caco-2 permeability of weakly basic drugs predicted with the double-sink PAMPA pKa(flux) method
[106]
논문
PAMPA--a drug absorption in vitro model 11. Matching the in vivo unstirred water layer thickness by individual-well stirring in microtitre plates
[107]
논문
P-glycoprotein deficient mouse in situ blood-brain barrier permeability and its prediction using an in combo PAMPA model
[108]
논문
A PAMPA study of the permeability-enhancing effect of new ceramide analogues
[109]
논문
The recent development of Biology
https://zenodo.org/r[...]
1904-12
[110]
논문
The electrical capacity of suspensions with special reference to blood
[111]
논문
On bimolecular layers of lipids on the chromocytes of the blood
[112]
논문
On bimolecular layers of lipids on the chromocytes of the blood
[113]
서적
The membranes of cells
Academic Press
[114]
논문
The ultrastructure of the intercalated discs of frog, mouse and guinea pig cardiac muscle
1958-04
[115]
논문
The molecular structure and contact relationships of cell membranes
[116]
논문
The ultrastructure of cell membranes and their derivatives
[117]
논문
Reconstitution of cell membrane structure in vitro and its transformation into an excitable system
1962-06
[118]
논문
Negative Staining of Phospholipids and Their Structural Modification by Surface-Active Agents As Observed in the Electron Microscope
[119]
논문
A totally synthetic bilayer membrane
[120]
웹사이트
実験医学Online「ベシクル」
https://www.yodosha.[...]
[121]
서적
赤血球
[122]
서적
分子細胞生物学
[123]
문서
[124]
서적
赤血球膜研究史
[125]
서적
クーパー細胞生物学
[126]
서적
図解分子細胞生物学
[127]
서적
分子細胞生物学
[128]
서적
図解分子細胞生物学
[129]
서적
細胞膜のしくみ
[130]
서적
細胞膜のしくみ
[131]
서적
赤血球膜研究史
[132]
서적
図解分子細胞生物学
[133]
서적
細胞膜のしくみ
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com


